Capacidad calorífica
La capacidad calorífica o capacidad térmica de un cuerpo es el cociente entre la cantidad de energía calorífica transferida a un cuerpo o sistema en un proceso cualquiera y el cambio de temperatura que experimenta. En una forma más rigurosa, es la energía necesaria para aumentar la temperatura de una determinada sustancia en una unidad de temperatura. Indica la mayor o menor dificultad que presenta dicho cuerpo para experimentar cambios de temperatura bajo el suministro de calor. Puede interpretarse como una medida de inercia térmica. Es una propiedad extensiva, ya que su magnitud depende, no solo de la sustancia, sino también de la cantidad de materia del cuerpo o sistema; por ello, es característica de un cuerpo o sistema particular. Por ejemplo, la capacidad calorífica del agua de una piscina olímpica será mayor que la de un vaso de agua. En general, la capacidad calorífica depende además de la temperatura y de la presión.
La capacidad calorífica (capacidad térmica) no debe ser confundida con la capacidad calorífica específica (capacidad térmica específica) o calor específico, el cual es la propiedad intensiva que se refiere a la capacidad de un cuerpo «para almacenar calor», y es el cociente entre la capacidad calorífica y la masa del objeto. El calor específico es una propiedad característica de las sustancias y depende de las mismas variables que la capacidad calorífica.
Calor específico
La capacidad calorífica específica, calor específico o capacidad térmica específica es una magnitud física que se define como la cantidad de calor que hay que suministrar a la unidad de masa de una sustancia o sistema termodinámico para elevar su temperatura en una unidad. En general, el valor del calor específico depende del valor de la temperatura inicial. Se le representa con la letra  (minúscula).
(minúscula).
 (minúscula).
(minúscula).
De forma análoga, se define la capacidad calorífica como la cantidad de calor que se debe suministrar a toda la masa de una sustancia para elevar su temperatura en una unidad (kelvin o grado Celsius). Se la representa con la letra 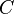 (mayúscula).
(mayúscula).
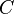 (mayúscula).
(mayúscula).
Por lo tanto, la capacidad calorífica específica es el cociente entre la capacidad calorífica y la masa, esto es 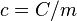 donde
donde 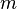 es la masa de la sustancia.
es la masa de la sustancia.
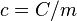 donde
donde 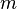 es la masa de la sustancia.
es la masa de la sustancia.Isócora o a volumen constante
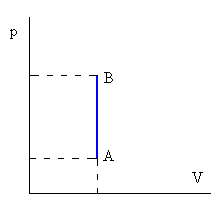 | No hay variación de volumen del gas, luego
W=0
Q=ncV(TB-TA)
Donde cV es el calor específico a volumen constante
|
Isóbara o a presión constante
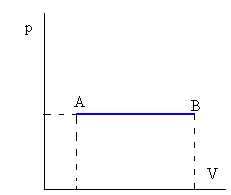 | W=p(VB-VA)
Q=ncP(TB-TA)
Donde cP es el calor específico a presión constante
|
Calores específicos a presión constante cP y a volumen constante cV
En una transformación a volumen constante dU=dQ=ncVdT
En una transformación a presión constante dU=ncPdT-pdV
Como la variación de energía interna dU no depende del tipo de transformación, sino solamente del estado inicial y del estado final, la segunda ecuación se puede escribir como ncVdT=ncPdT-pdV
Empleando la ecuación de estado de un gas ideal pV=nRT, obtenemos la relación entre los calores específicos a presión constante y a volumen constante
cV=cP-R
Para un gas monoatómico
Para un gas diatómico
La variación de energía interna en un proceso AB es ΔU=ncV(TB-TA)
Se denomina índice adiabático de un gas ideal al cociente.
Ecuación de estado
En física y química, una ecuación de estado es una ecuación constitutiva para sistemas hidrostáticos que describe el estado de agregación de la materia como una relación matemática entre la temperatura, la presión, el volumen, la densidad, la energía interna y posiblemente otras funciones de estado asociadas con la materia.
Una ecuación de estado es una
ecuación que relaciona, para un sistema en equilibrio
termodinámico, las variables
de estado que lo describen. Tiene la forma general:
No existe una única ecuación de estado que
describa el comportamiento de todas las sustancias para todas las condiciones
de presión y temperatura.
Ecuación de balance de energía
Los dos primeros tipos de energía son energías de transferencia, es decir solo se presentan cuando el entorno y el sistema se encuentran en estados diferentes, por lo cual esta energía se transfiere para alcanzar un equilibrio termodinámico:
- Trabajo (W):
Es una forma de energía que representa una transferencia entre el sistema y el entorno. Y en general se manifiesta por presentar una fuerza mecánica. El trabajo no es posible almacenar trabajo debido a que es una energía en transito. Y su signo depende si se lo realiza el sistema (-) o el entorno hacia el sistema (+). Para que una fuerza mecánica realice un trabajo la frontera de sistema debe moverse:

Donde F es la fuerza mecánica que actúa para provocar un desplazamiento de las fronteras del sistemas en la dirección s, sea del entorno al sistema o visceversa la fuerza que actúa, para cambiar del Estado 1 al Estado 2. Sin embargo el trabajo es difícil de calcular debido a: (a) Dificultad en medir el desplazamiento del sistema y (b) la integral F*ds no siempre da un mismo resultado para las diferentes formas de transformación (efecto de la trayectoria)
Por estas razones se debe especificar el proceso o trayectoria por la cual se realiza el trabajo, desde el estado inicial al estado final. Es decir la integral F*ds puede tener cualquier valor para la variación de dos estados, y este valor dependerá de la trayectoria para llegar al otro.
Razón por la cual es mas conveniente utilizar la siguiente integral, que utiliza las propiedades termodinámicas que definen un sistema:

Donde P es la presión que ejerce el sistema y V el volumen que se encuentra el sistema en un estado. A partir de esta ecuación podemos calcular el trabajo usando la trayectoria de un proceso. Ej. Para gases por ejemplo podemos usar los siguientes procesos:
Proceso Isotérmico (Temperatura constante):


Proceso Isobárico (Presión Costante)



No hay comentarios.:
Publicar un comentario